PRACTICA # 2 «DETERMINACION DE PROTEINAS»
PRÁCTICA Nº2:
DETERMINACION DE PROTEINAS
METODO DE BIURET
Equipo N° 1:
Gómez Gutiérrez Gabriel
De la Luz Rodríguez Paulina
Vargas de la Mora Mario Alberto
Ramírez Gómez Tania Alejandrina
Almada Ávila Gabriel
Materia: Energía y Consumo de Sustancias Fundamentales
Maestro: Jorge Joel Reyes Méndez
Trimestre: 3º
PRÁCTICA Nº2: DETERMINACION DE PROTENAS
OBJETIVOS:
- Manejar en el laboratorio el método de Biuret para determinar proteínas
- Observar y determinar experimentalmente el efecto del pH sobre las proteínas de la leche
MATERIAL:
ü 1probeta de 50 ml
ü 2 gradillas
ü 2 pipetas de 10 ml
ü 3 pipetas de 5 ml
ü 1 pipeta de 1 ml
ü 12 tubos de 15x 100
ü 1 vaso de precipitado de 100ml
ü 12 tubos de 16 x 150
ü 1 balanza granataria
ü Papel parafilm para 10 tubos
ü 1 embudo y papel filtro
MATERIAL POR EQUIPO:
Franela
Jabón
Cloro
6gr. Aproximadamente de leche en polvo descremada
Masking-Tape, plumón de tinta indeleble.
REACTIVOS:
Agua destilada
Solución de ácido acético 0.1N
Solución de acetato de sodio 0.1N.
Solución de caseína (concentración 4mg / ml)
Reactivo de biuret 50 ml.
APARATOS POR EQUIPO:
1 centrifuga clínica
1 balanza granataria
2 espectrofotómetros
4 celdas
INTRODUCCIÓN:
A) CASEINA
La leche contiene vitaminas (principalmente tiamina, riboflavina, ácido pantoteico y vitaminas A, D y k), minerales (calcio, potasio, sodio, fosforo y metales en pequeñas cantidades), proteínas (incluyendo todos los aminoácidos esenciales), carbohidratos (lactosa) y lípidos. Los únicos elementos importantes de los que carece la leche son el hierro y la vitamina C.
Las proteínas se pueden clasificar de manera general en proteínas globulares y fibrosas. Las proteínas globulares son aquellas que tienden a agregarse en formas esferoidales y no establecen interacciones intermoleculares como son los puentes de hidrogeno (característico de las proteínas fibrosas) siendo solubilizadas en suspensiones coloidales
En al leche hay tres clases de proteínas: caseína, lactato albuminas y lactato globulinas (todas globulares).
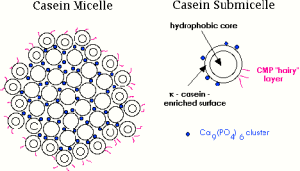
La caseína es una proteína conjugada de la leche del tipo fosfoproteína que se separa de la leche por acidificación y forma una masa blanca. Las fosfoproteínas son un grupo de proteínas que están químicamente unidas a una sustancia que contiene acido fosfórico, en la caseína la mayoría de los grupos fosfato están unidos por los grupos hidroxilo de los aminoácidos serina y treonina. La caseína en la leche se encuentra en forma de sal cálcica (caseinato cálcico). La caseína representa cerca cerca del 77% al 82% de las proteínas presentes en la leche y el 2.7 % en composición de la leche liquida.
La caseína esta formada por α (s1), α (s2), β caseína y kappa- caseína formando una micela o unidad soluble. Ni la alfa ni la beta caseína son solubles en la leche, solas o combinadas. Si se añade la kappa caseína a las dos anteriores o a cada una de ellas por separado se forma un complejo de caseína que es solubilizado en forma de micela. Esta micela esta solubilizada por la kappa caseína mientras que las alfas y betas son fosfoproteínas que precipitan de iones calcio.
O O
‖‖ ‖‖
Proteína – O –P – O- + Ca2+ proteína – O – P- O – O-Ca2+
‖‖ ‖‖
O ̠ O ̠
Insolubles
La kappa caseína, sin embargo, tiene pocos grupos fosfato y un alto contenido d carbohidratos unidos a ella. También tiene todos sus residuos de serina y treonina con sus correspondientes grupos hidroxilo, así como los carbohidratos dispuestos en una sola cara de su superficie por lo que esta parte exterior es fácilmente soluble en agua gracias a los grupos polares que posee. La otra parte de su superficie se une fácilmente al alfa y la beta caseína insoluble, lo que da lugar a la formación de la micela.
La propiedad característica de la caseina es su baja solubilidad a pH 4,6. El pH de la leche es 6,6 aproximadamente, estando a ese pH la caseina cargada negativamente y solubilizada como sal cálcica. Se añade acido a la leche, la carga negativa de la superficie de la micela se neutraliza (los grupos fosfato se protonan) y la proteína neutra precipita
Ca2+ Caseinato + 2HCl Caseína + CaCl2
La conformación de la caseina es similar a las proteínas desnaturalizadas globulares. El alto numero de residuos de prolina en la caseina causa un especial plegamiento en la cadena de proteína e inhibe la formación de una fuerte y ordenada estructura secundaria. La caseina no contiene puentes di sulfuro. De igual manera la falta de estructura secundaria es importante para la estabilidad de la caseina frente a la desnaturalización por calor. La carencia de estructura terciaria facilita la situación al exterior de los residuos hifrofóbicos lo que facilita la unión entre unidades proteicas y la convierte en prácticamente insolubles en agua. En cambio es fácilmente dispersable en álcalis diluidas y en soluciones salinas tales como oxalato sódico y acetato sódico.
b) PUNTO ISOLECTRICO
Todas las macromoléculas de la naturaleza adquieren una carga cuando se dispersan en agua. Una característica de las proteínas y otros biopolímeros es que la carga toral que adquieren depende del pH del medio.
Asi, todas las proteínas tienen una carga neta dependiendo del pH del medio en el que se encuentren y de los aminoácidos que la componen, así como de las cargas de cualquier ligando que se encuentre unido a la proteína de forma covalente (irreversible).
Debido a la composición en aminoácidos de la proteína, los radicales libres pueden existir en tres formas dependiendo del pH del medio: catiónicos, neutros y aniónicos.
Cualquier proteína tendría una carga neta positiva si se encuentra en un medio lo suficientemente acido debido a que los grupos COOH de los aminoácidos aspártico y glutámico estarían en su forma neutra pero los grupos amino de Arginina y lisina estarían protonados (-NH3+)
De igual forma si la proteína se encuentra en un medio con un pH muy alto estaría cargada negativamente ya que en este caso los grupos carboxilo estarían des protonados (COO-) y los grupos amino estarían en su forma neutra (NH2).
c) ley de Beer- Lambert
Esta ley expresa la relación entre absorbancia de la luz monocromática 8de longitud de onda fija) y concentración de un cormoforo en solución:
A= log l/lo= ε ∙c∙l
La absorbencia de una solución es directamente proporcional a su concentración- a mayor numero de moléculas mayor interacción de la luz con ellas-; también depende de la distancia que recorre la luz por la solución- a igual concentración, cuanto mayor distancia recorre la luz por la muestra mas moléculas se encontrara-; y por ultimo, depende de ε, una constante de proporcionalidad- denominada coeficiente de extinción- que es especifica de cada cromóforo. Como A es a dimensional, las dimensiones de ε dependen de la c y l. la segunda magnitud (l) se expresa siempre en cm mientras que la primera se hace, siempre que sea posible, en M, con lo que las dimensiones de ε resultan ser M-¹ cm -¹. Este coeficiente asi expresado, en términos de unidades de concentración molar (o un submúltiplo apropiado), se denomina coeficiente de extinción molar ( εM). Cuando, por desconocerse el peso molecular del soluto, la concentración de la dilusion se expresa en otras unidades distintas de M, por ejemplo g. L-¹, las dimensiones de ε resultan ser distintas, por ejemplo g-¹. L cm -¹, y al coeficiente asi expresado se denomina coeficiente de extinción especifico (εs).
La ley de Lambert- Beer se cumple para soluciones diluidas; para valores de c altos, ε varia con la concentración, debido a fenómenos de dispersión de la luz, agregación de moléculas, cambios del medio, etc.
D) TRANSMITANCIA (T)
La transmitancia de una sustancia en solucion es la relación entre la cantidad de luz transmitida que llega al detector una vez que ha atravesado la muestra, It,Y la cantidad de luz que incidio sobre ella, Io, y se representa normalmente en tanto por ciento: % T= It/Io x 100
La trasmitancia nos da una medida física de la relación de intensidad incidente y trasmitida al pasar por la muestra. La relación entre % T y la concentración no es lineal, pero asume una relación logarítmica inversa.
e) ABSORBANCIA (A)
absorbancia s un concepto mas relacionado con la muestra puesto que nos indica la cantidad de luz absorbida por la misma, y se define como el logaritmo de 1/T en consecuencia :
A = log 1/T = -log T = -log It/ Io.
Cuando la intensidad incidente y trasmitida son iguales (lo= lt), la trasmitancia es del 100% e indica que la muestra no absorbe a una determinada longitud de onda, y entonces A vale log 1= 0
La cantidad de luz absorbida dependerá de la distancia que atraviesa la luz a través de la solución del cromóforo y de la concentración de este
F) ESPECTOFOTOMETRO
Sirve para medir; en función de la longitud de onda, la relación entre valores de una misma magnitud fotométrica relativa a 2 haces de radiación y la concentración o reacciones químicas que se miden en una muestra
Pueden ser de absorción atómica o de masa y visuales
Tiene la capacidad de proyectar un haz de la luz monometrica a través de un muestra y medir la cantidad de luz que es absorbida por dicha muestra, eso permite realizar 2 funciones
- Dar información sobre la naturaleza de la sustancia
- Indicador directamente que la cantidad de la sustancia que interesa esta presente en la muestra
g) BIURET
La presencia de proteínas en una mezcla se puede determinar mediante la reacción del Biuret. El reactivo de Biuret contiene CuSO4 en solución acuosa alcalina (gracias a la presencia de NaOH o KOH). La reacción se basa en la formación de un compuesto de color violeta, debido a la formación de un complejo de coordinación entre los iones Cu2+ y los pares de electrones no compartidos del nitrógeno que forma parte de los enlaces peptídicos.
La reacción debe su nombre al biuret, una molécula formada a partir de dos de urea (H2N-CO-NH-CO-NH2), que es la más sencilla que da positiva esta reacción, común a todos los compuestos que tengan dos o más enlaces peptídicos consecutivos en sus moléculas
H) ECUACION HENDERSON HASSELBACH
Considera la ionización de un ácido débil HA que tiene algún valor de pKa. Es conveniente poder relacionar el pH de una disolución de un ácido débil con su pKa y con el grado de ionización. La reacción sería:
HA H+ + A–
La constante de disociación del ácido (Ka) para esta reacción, vendría dada por la ecuación
Esta ecuación se puede reorganizar para despejar la concentración de iones hidrógeno porque, recuerda, queremos una ecuación que relacione el pH de la disolución con el pKa y con el grado de ionización del ácido débil. La forma en la que queda la ecuación es
Por definición, log (1/ [H+]) = pH y log (1/Ka) = pKa, así que, aplicando logaritmos a la ecuación anterior, obtenemos
Esta es la conocida ecuación de Henderson-Hasselbalch que se utiliza a menudo para realizar los cálculos que requiere la preparación de disoluciones tampón en el laboratorio, o para otras aplicaciones. Fíjate en varios aspectos interesantes relacionados con esta ecuación.
Primero, si pH = pKa, el logaritmo de la relación de concentraciones de las formas disociada y sin disociar será cero, de manera que estas concentraciones serán iguales. En otras palabras, cuando el pH es igual al pKa, el ácido estará disociado al 50%.
Segundo, cuando el pH aumenta o disminuye una unidad en relación con el pKa, la relación entre las formas del ácido disociado y sin disociar cambia en un factor de 10. Es decir, si el pH de una disolución es 6 y el pKa es 7, la relación [A–]/[ HA] será 0,1; si el pH fuera 5, la relación sería 0,01 y si el pH fuera7, la relación sería 1.
También, si el pH está por debajo del pKa, la relación es < 1, mientras que si el pH está por encima del pKa, la relación será >1. Resumiendo, la ecuación de Henderson-Hasselbalch aporta mucha información. Debes estudiarla para comprender todo lo que deriva de ella.
DESARROLLO:
- 1. DETERMINACIÓN DEL PUNTO ISOELECTRICO
1.1 preparación de una serie de tubos con solución amortiguadora de acetatos. Coloca en una gradilla 6 tubos de 15 x 100 rotulados con números consecutivos.
Adiciona a cada tubo las soluciones acido acético y acetato de sodio que indica la siguiente tabla:
| tubo | Solución acido acético 0.1N | Solución acetato de sodio 0.1 N |
| 1 | 5ml | |
| 2 | 4ml | 1ml |
| 3 | 3ml | 2ml |
| 4 | 2ml | 3ml |
| 5 | 1ml | 4ml |
| 6 | 5ml |
El volumen final de cada tubo deberá ser de 5 ml.
- 2. PREPARACION DE LA LECHE
2.1 En un vaso de precipitado de 100ml disuelve 6gr. De leche en polvo descremada, con 560ml de agua destilada
NOTA: añade el agua poco a poco para evitar que se formen grumos que podrían dificultar la obtención de una solución homogénea. No debes calentar la leche para disolverla.
2.2 en un tubo de ensaye de 16 x 150 mm mide 2 ml de la leche rehidratada preparada como se indico anteriormente y añade 8 ml de agua destilada, agita cuidadosamente por inversión. Esta muestra de leche diluida (1:5) se ocupara para llevar a cabo la determinación del punto isoeléctrico de las proteínas descrito en el siguiente párrafo:
- 3. PUNTO ISOELECTRICO
3.1 Añade 1ml de la leche diluida (1:5) a cada tubo de solución amortiguadora que preparaste en el punto 1
3.2 Mezcla cuidadosamente por inversión todos los tubos y deja reposar por espacio de 10 min. Observa el aspecto de las mezclas preparadas. En el tubo donde observes grumos de leche suspendidos en la solución te indicara que las proteínas de la leche se han insolubilizado debido al pH de la solución este pH es denominado PUNTO ISOELECTRICO
3.3 Centrifuga los tubos a 2500 r.p.m durante 10 min NO SIN ANTES BALANCEARLOS. Deberán pesar lo mismo que aquel tubo que ocupara e lugar opuesto dentro de la centrifuga
3.4 Separa el sobrenadante ( cuidando de no suspender el precipitado acumulado en el fondo del tubo) y transfiere a tubos limpios de 15 x 100 rotulados con el numero de tubos que les corresponde
- 4. DETERMINACIÓN DE PROTEÍNAS CON EL METODO DE BIURET
4.1 COLOCA EN UNA GRADILLA 11 tubos de 16 x 150 mm, rotula uno de ellos como numero cero, el cual llevara los reactivos para calibrar el espectrofotómetro (blanco de reactivos o testigo) los siguientes 4 tubos llevaran números consecutivos del 1 al IV y los restantes (del 1 al 6) los rotularas con el numero que corresponda a los sobrenadantes obtenidos por centrifugación según se indico en el punto 3.4
4.2 Añade a cada tubo los reactivos para determinar proteínas en la curva de calibración (tubos I a IV) y en los sobrenadantes (tubos 1 a 6) de acuerdo a lo indicado en la siguiente tabla:
CURVA DE CALIBRACIÓN TUBOS DE PROBLEMA
| Tubo | 0 | I | II | III | IV | V | 1 | 2 | 3 | 4 | 5 | 6 | ||
| Solución Patrón
4 mg/ml |
0 ml | 0.2 ml | 0.4 ml | 0.6 ml | 0.8 ml | 1 ml | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Sobrenadante | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | 0 | 0 | 0 | 0 | 0 | ||
| Sobrenadante | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | 0 | 0 | 0 | 0 | ||
| Sobrenadante | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | 0 | 0 | 0 | ||
| Sobrenadante | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | 0 | 0 | ||
| Sobrenadante | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | 0 | ||
| Sobrenadante | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.5 | ||
| Agua | 1 ml | 0.8 ml | 0.6 ml | 0.4 ml | 0.2 ml | 0 ml | 0.5 ml | 0.5 ml | 0.5 ml | 0.5 ml | 0.5 ml | 0.5 ml | ||
| Reactivo de Biuret (ml) | 4.0 ml a todos los tubos | |||||||||||||
NOTA: mezcla cuidadosamente cada reactivo y deja en reposo 30 min para favorecer el desarrollo de color. Antes de iniciar tus lecturas en el espectrofotómetro, previo calentamiento de 15´, es necesario calibrarlo con el blanco de reactivos a una absorbancia de cero, con una longitud de onda de 570 mm
Si observas alguna turbidez en alguno de los tubos, es conveniente que filtres antes de hacer la lectura.
- 5. RESULTADOS
| Tubo | I | II | III | IV | 1 | 2 | 3 | 4 | 5 | 6 |
| D.O | 0.082 | 0.121 | 0.163 | 0.202 | 0.048 | 0.046 | 0.048 | 0.050 | 0.059 | 0.048 |
| Mg. De proteína | 0.8 | 1.6 | 2.4 | 3.2 | 0.024 | 0.023 | 0.024 | 0.025 | 0.02 | 0.024 |
| Proteína | mg/ml | Mg/100ml |
| Sobrenadante 1 | 0.025 | 2.5 |
| Sobrenadante 2 | 0.024 | 2.4 |
| Sobrenadante 3 | 0.049 | 4.9 |
| Sobrenadante 4 | 0.024 | 2.4 |
| Sobrenadante 5 | 0.04 | 4 |
| Sobrenadante 6 | 0.236 | 2.36 |



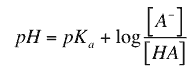
Deja un comentario